浙江小分子与酶蛋白间的相互作用测试——清析客户检测案例
类别:客户案例
 641
641
 2022-11-25
2022-11-25
 641
641
 2022-11-25
2022-11-25
2022年10月12日,本人接到来自浙江某大学的客户咨询,于第一时间与客户取得联系并了解客户的计算需求,具体沟通情况如下;
客户背景
客户是来自浙江某大学的同学,研究课题为:模拟探究小分子与5VZW酶蛋白、6QAJ酶蛋白间的相互作用方式、作用位点、以及作用位点与促进/抑制作用是否有关联的预测。
模型名称
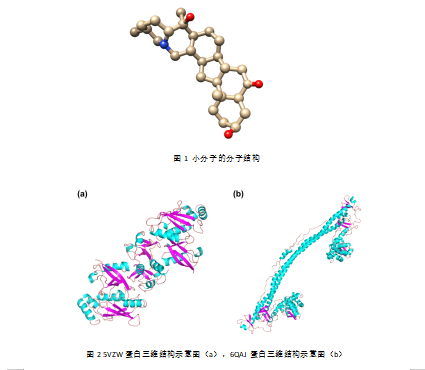
5VZW蛋白三维结构、6QAJ蛋白三维结构、客户要求的特定小分子(如下图结构所示)

客户需求
通过分子对接方法研究小分子与5VZW和6QAJ酶蛋白间的相互作用,期望模拟结果可以表明小分子能很好的结合到两个酶蛋白表面的活性空腔中,并且小分子与5VZW和6QAJ酶蛋白的作用位点确定与抑制作用是否存在一定关联。
解决方案
(1)受体结构准备
将从蛋白晶体结构数据库中得到的蛋白晶体结构(PDB Code:5VZW;PDB Code:6QAJ)作为初始结构用于后续的分子对接。初始结构用AutoDock Tools 1.5.6进行处理,保存蛋白原有电荷,并生成pdbqt文件用于对接。
(2)配体结构准备
小分子结构通过chemdraw构建,使用MOPAC程序优化分子结构并计算PM3原子电荷用于后续分子对接,采用AutoDock Tools 1.5.6处理配体结构,生成pdbqt文件用于对接。
(3)分子对接方法
根据客户提供的信息,未明确小分子化合物在两个酶蛋白上的结合位点,因此,本研究采用全局对接将小分子分别与两个蛋白进行对接(如图2所示),以此探究小分子在两个酶蛋白分子中的潜在结合位点。分子对接采用AutoDock 4.2.6软件包实现,对接盒子包含整个蛋白结构,对接次数设为100,其余参数采用默认值。
(4)对接结果优化
分子对接的结果在空间结构上可能有不合理的原子接触,可以采用能量优化的方法对这些作用力进行释放,使其更趋于稳定结构。能量优化采用Amber14力场,优化过程分两步进行:先进行1000步的最陡下降法(Steepest Descent Method)优化,再用500步的共轭梯度法(Conjugate Gradient Method)对结构进行进一步优化,并将最终的结果作为后续分析的模型。
根据客户要求的建模如下图所示:
客户反馈
根据我们最终的分子动力学模拟,能够通过数据得出小分子与5VZW和6QAJ酶蛋白间存在相互作用,结果表明小分子能很好的结合到两个酶蛋白表面的活性空腔中,小分子与酶蛋白的作用位点已确定、并且二者相互作用产生抑制作用有一定的理论依据。模拟结果符合客户预期、数据图清晰、沟通过程细致耐心,客户反馈很好。











 823
823